丂丂丂丂丂丂丂丂丂丂丂丂丂朏崄懓壔崌暔偺幚尡丂乮侾乯
丂丂儀儞僛儞娐傪巒傔偲偡傞 乽朏崄懓扽壔悈慺乿偼丄俇妏宍偺扽慺偺崪慻傒偑嶌傞暯柺忋傪 揹巕偺塤偑庢傝姫偄偰嫟柭忬懺乮亖兾揹巕塤乯偵偁傞堦孮偺検巕椡妛揑偵埨掕側壔崌暔傪尵偄丄儀儞僛儞娐乮儀儞僛儞丄僩儖僄儞丄僉僔儗儞丄價僼僃僯儖側偳乯丄弅崌娐乮僫僼僞儗儞丄傾儞僩儔僙儞丄僼僃僫儞僩儗儞丄僺儗儞側偳乯偑偁傞丅 乭朏崄懓乭偲偄偆柤慜偼丄侾俋悽婭偵 堦晹偺朏崄傪帩偮壔崌暔偺嫟捠峔憿偩偭偨偙偲偐傜偮偄偨偑丄尰嵼偼丄偦傟傜傪婎偵偟偨旕忢偵懡婒偵傢偨傞壔崌暔偺堦孮傪尵偆傛偆偵側偭偨丅丂弅崌娐偺偁傞傕偺傗 朏崄懓傾儈儞丄僯僩儘僜壔崌暔側偳偼丄撆惈傗敪偑傫惈傪帩偮傕偺偑懡偄丅
丂丂們倖丏丂娐峔憿偵扽慺埲奜偺尦慺偑擖偭偨暔偼乽暋慺娐壔崌暔乿偲尵偆丅乮俷丗 僼儔儞丄俶丗 僺儘乕儖丄僺儕僕儞丄 俽丗 僠僆僼僃儞 側偳乯丄 暋慺弅娐乮俶丗僀儞僪乕儖側偳乯丄
丂丂傑偨丄亅俠俫2亅峔憿偺帀朾懓扽壔悈慺偑娐偵側偭偨 乽帀娐幃壔崌暔乿 僔僋儘僾儘僶儞丄僔僋儘儁儞僞儞丄僔僋儘僿僉僒儞丄 僥儖儁儞丄僗僥儕儞側偳丄丂偺堦孮偑偁傝丄偙傟傜偼帀朾懓偺惈幙傪帩偮丅乯
丂丂朏崄懓扽壔悈慺偺嵟傕娙扨側傕偺偱偁傞 儀儞僛儞偼丄俇屄偺扽慺娐偺暯柺忋傪儅僀僫僗偵懷揹偟偨俇屄偺揹巕塤偑奜偵弌偰嫟柭偟偰偄傞忬懺側偺偱丄僾儔僗偵懷揹偟偨乮亖梲僀僆儞偺乯乽媮揹巕帋栻乿偑懚嵼偡傞偲丄悈慺僀僆儞偲抲姺斀墳傪婲偙偟丄僯僩儘婎丄僗儖儂儞婎丄僴儘僎儞婎側偳偑晅壛偝傟偰偄偔摿挜偑偁傞丅 娚偄斀墳忦審偱偼 儌僲乮侾屄乯丄 忦審傪嫮偔偡傞偲 僕乮俀屄乯丄僩儕乮俁屄乯側偳偺抲姺偑弴師峴傢傟傞丅
丂丂侾丏丂僯僩儘儀儞僛儞偺嶌惉丗丂晠怘丒傗偗偳拲堄
丂丂僯僩儘壔抲姺斀墳偼丄媮揹巕抲姺斀墳偱偁傝 棸巁偺扙悈嶌梡偵傛偭偰揹棧偟偨 僯僩儘僯僂儉僀僆儞 俶俷2亄偑 儀儞僛儞娐忋偺悈慺傪亄僀僆儞偲偟偰捛偄弌偟乮棸巁悈慺僀僆儞俫俽俷4亅偑堷偭挘傝乯丄僯僩儘婎偑儀儞僛儞娐偺堦妏偵廂傑傞丅
丂丂丂丂丂俫俷亅俶俷2丂亄丂俀 俫2俽俷4丂佁丂俫3俷亄丂亄丂俀 俫俽俷4亅丂亄丂俶俷2亄 乮僯僩儘僯僂儉僀僆儞乯丄
丂丂丂丂丂
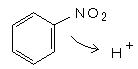 丄丂丂丂丂俫俽俷4亅丂亄丂俫亄丂仺丂俫2俽俷4 乮巁怗攠乯
丄丂丂丂丂俫俽俷4亅丂亄丂俫亄丂仺丂俫2俽俷4 乮巁怗攠乯丂丂椻媝偟側偑傜丄俆侽侽們們僼儔僗僐偵丄徤巁乮俇侽亾乯 侾侽侽倣倢 傪擖傟丄 棸巁乮俋俈亾乯 侾侾係倣倢 傪彮偟偢偮壛偊偰丄崿巁傪嶌偭偰偍偔丅乮棸丒徤巁 庢埖拲堄乯丂椻媝偟側偑傜丄偙傟偵儀儞僛儞乮倐倫丏俉侽丏侾亷乯 俉俇倣倢 傪丄壏搙偑忋偑傜側偄傛偆偵拲堄偟偰乮偱偒傟偽昘椻偟偰乯丄俁侽暘偐偗偰揌壓偟丄傛偔怳傝崿偤傞丅丂揌壓偑廔傢偭偨傜丄俇侽搙偺搾偵捫偗側偑傜 栺俁侽暘怳傝崿偤傞丅僼儔僗僐傪帩偭偰怳傝崿偤傞偲偒偼僑儉庤戃傪偡傞丅搾偼壗夞傕岎姺偡傞丅丂乮仏丂俇侽亷埲忋偵忋偘傞偲 僕僯僩儘傗僩儕僯僩儘儀儞僛儞偑偱偒偰敋敪惈偲側傞偺偱拲堄乯
丂丂暘塼儘乕僩偵擖傟丄忋憌傪庢傞丅乮壓憌偼巁側偺偱丄懡検偺廳憘偱拞榓偟偰幪偰傞乯丄丂嵞傃暘塼儘乕僩偵擖傟丄悈偲嫟偵怳傝丄傕偆堦搙悈偲怳傝丄偝傜偵侾侽亾廳憘悈偲怳偭偰巁傪姰慡偵彍偔丅丂柍悈墫壔僇儖僔僂儉乮棻忬丄俀侽倗乯偲傛偔怳傝崿偤姡憞偝偣傞丅乮塼偼悈暘偑敳偗偰摟柧偵側傞乯丂偙偺塼偲丄巆傝傪僕僋儘儘儊僞儞乮倐倫丏俁俋丏俇亷丄悢倣倢乯偱愻偭偨愻塼傪丄忲棷僼儔僗僐偵擖傟僆僀儖僶僗偱忲棷偡傞丅丂乮桘偺壏搙偱丄乯侾俇侽亅侾俉侽亷乮儁儞宆壏搙寁乮儌僲僞儘僂乯乯偺棷暘偼僕僋儘儘儊僞儞傗枹斀墳偺儀儞僛儞側偺偱 幪偰丄俀侾侽亅俀俁侽亷偺棷暘傪庢傞丅乮寉偔庤摦億儞僾偱尭埑乯丂乮僼儔僗僐偺掙偵偄偔傜偐巆傞忲棷巆熢乮妼怓乯偼敋敪惈側偺偱丄彮偟巆偟偰忲棷傪廔偊傞乯丂僾儔僗僠僢僋偺僼儔僗僐丒僗僩僢僷乕乮椢怓乯偼俀侽侽亷傪挻偊傞偲梟偗傞偺偱丄巊傢側偄偐 嬥懏惢傪梡偄傞丅
丂丂僯僩儘儀儞僛儞 俠6俫5俶俷2丂俵亖侾俀俁丏侾丄倐倫丏俀侾侽丏俋亷丄倣倫丏俆丏俈亷丄兿侾丏俀乯丄丂埲忋偺憖嶌傪俀夞峴側偄丄廂検栺俀侽侽倗丅
丂丂


丂丂俀丏丂傾僯儕儞偺嶌惉丗丂晠怘拲堄
丂丂傾僯儕儞乮俵亖俋俁丏侾俁丄倐倫丏侾俉係丏侾亷丄兿侾丏侽俀乯偼丄僯僩儘儀儞僛儞傪 庎 亄 俫俠倢丄偁傞偄偼丄揝 乮亄墫慺僀僆儞乮怗攠乯乯偱娨尦偟偰嶌傜傟傞丅
丂丂丂丂丂
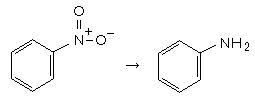
丂丂俆侽侽倣倢僼儔僗僐偵丄庎乮俽値乯 係俈倗丄 僯僩儘儀儞僛儞乮俠6俫5俶俷2丄倐倫丏俀侾侽丏俋亷乯俀侽倣倢傪擖傟丄備偭偔傝偲墫巁乮俁俆亾乯侾俀侽倣倢傪揌壓偟丄弶傔偼敪擬偡傞偑丄偦偺屻偼帪乆壏傔側偑傜丄俀侽暘傎偳傛偔怳傝崿偤傞丅 僯僩儘儀儞僛儞偺憌偑側偔側偭偰扨堦憌偵側偭偰偄傞偙偲傪妋擣丅乮斀墳偺廔揰乯丂擹偄悈巁壔僫僩儕僂儉乮俶倎俷俫 俈侽倗/悈侾俆侽倣倢乯傪偁傜偐偠傔嶌偭偰椻傑偟偰偍偒丄傛偔椻傗偟側偑傜壛偊傞偲丄傾僯儕儞偑梀棧偡傞丅乮庎巁偼偁傞掱搙巆傝丄倫俫偑忋偑傜偢丄撍暒偣偢偵忲棷偱偒傞丅乯
丂丂僆僀儖僶僗偱丄乮桘偺壏搙偱乯侾俁侽亅侾俇侽亷偺棷暘傪庢傞丅傾僯儕儞偼悈偲嫟暒崿崌暔乮俋俉丏俆亷乯傪嶌傞偺偱丄悈偲嫟偵忲棷偝傟傞丅丂棷塼偵怘墫傪朞榓傑偱梟偐偟偰墫愅偟偰偐傜 暘塼楻搇偵擖傟丄忋憌傪庢傞丅乮傾僯儕儞偼兿亖侾丏侽俀偱悈偲傎傏摨偠側偺偱斾廳偱暘偗丄傑偨丄悈偵庒姳梟偗傞偺偱丄偙偺傛偆偵墫愅偡傞乯
丂丂偦偺屻偼丄検偑懡偗傟偽屌宍偺悈巁壔僫僩儕僂儉偱乮墫僇儖偼晄壜乯姡憞偟偰傕偆堦搙忲棷偡傞強丄崱夞彮側偄偺偱丄僕僄僠儖僄乕僥儖傪壛偊偰怳傝丄偦偺忋憌傪偦偺傑傑娗價儞偵擖傟丄儂僢僩僾儗乕僩偱僄乕僥儖傪旘偽偟偨丅丂丂廂検丗丂栺侾俆倗
丂丂仏丂傑偨丄揝偲丄怗攠儗儀儖偺墫慺僀僆儞傪梡偄傞 儀僔儍儞乮Bechamp乯娨尦朄偼丄岺嬈揑偵峴傢傟偰偒偨丅丂乮嬤擭偼俶倝丄俠倳怗攠偵傛傞悈慺偵傛傞僯僩儘儀儞僛儞偺捈愙娨尦傕岺嬈揑偵峴傢傟偰偄傞丅乯
丂丂偙偺斀墳偼丄揝偑丄巐嶰巁壔揝偵巁壔偝傟傞夁掱偱丄僯僩儘儀儞僛儞偑娨尦偝傟丄墫慺僀僆儞偼怗攠偲偟偰嶌梡偡傞丅丂僯僩儘儀儞僛儞 俀侽倣倢丄 揝暣 係侽倗乮夁忚検乯丄 墫壔揝乮嘨乯乮俥倕俠倢3丒俇俫2俷乯 俆倗傪悈侾侽侽倣倢偵梟偐偟偨傕偺傪崿偤丄寢峔丄敪擬偟偨丅 偨偩偟丄斀墳偺廔揰偑暘偐傝偵偔偔丄捑揳暔偑懡偄偺偱撍暒偟傗偡偔傗傗戝妡偐傝側悈忲婥忲棷埲奜偱偼忲棷偟偵偔偄偺偑寚揰偱偁傞丅丂嵽椏旓偼庎傛傝偼傞偐偵埨偄丅乮拞崙惢偺庎棻侾侽侽倗偱俀侽侽侽墌埵乯
丂丂丂丂丂俠6俫5俶俷2丂亄丂俁 俥倕丂亄丂俇 俫俠倢丂仺丂俠6俫5俶俫2丂亄丂俁 俥倕俠倢2丂亄丂俫2俷丄
丂丂丂丂丂俠6俫5俶俷2丂亄丂俇 俥倕俠倢2丂亄丂俇 俫俠倢丂仺丂俠6俫5俶俫2丂亄丂俇 俥倕俠倢3丂亄丂俀 俫2俷丄
丂丂丂丂丂俥倕俠倢2丂亄丂俀 俥倕俠倢3丂亄丂係 俫2俷丂仺丂俥倕3俷4伀丂亄丂俉 俫俠倢
丂丂丂亪丂係 俠6俫5俶俷2丂亄丂俋 俥倕丂亄丂係 俫2俷丂仺丂係 俠6俫5俶俫2丂亄丂俁 俥倕3俷4伀
丂

丂丂

丂丂俁丏丂僽儘儌儀儞僛儞偺嶌惉丗丂晠怘丄姺婥拲堄
丂丂僴儘僎儞壔丄廘慺偺晅壛斀墳偱偼丄巁怗攠乮棸巁乯傪梡偄偢丄揝傪怗攠偲偟偰丄摨條偵丄廘慺梲僀僆儞 俛倰亄 偑媮揹巕帋栻偲側偭偰丄廘慺偑晅壛偟丄悈慺僀僆儞偑庢傟偰廘壔悈慺偑弌傞丅乮墫慺偺応崌傕摨條乯
丂丂丂丂丂俛倰亅俛倰丂亄丂俥倕俛倰3丂仺丂俛倰亄 乮廘慺梲僀僆儞乯丂亄丂俥倕俛倰4亅 乮廘壔揝巁僀僆儞乯丄
丂丂丂丂丂
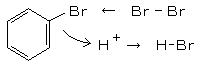 丄丂丂丂亪丂俠6俫6丂亄丂俛倰2丂仺丂俠6俫5俛倰丂亄丂俫俛倰 仾
丄丂丂丂亪丂俠6俫6丂亄丂俛倰2丂仺丂俠6俫5俛倰丂亄丂俫俛倰 仾丂丂廘壔僇儕僂儉乮俲俛倰丄俵亖侾侾俋丏侽乯乮係侽倗/侾侽侽倣倢悈乯偵丄夁棸巁傾儞儌僯僂儉乮儁儖僆僉僜擇棸巁傾儞儌僯僂儉丄乮俶俫4乯2俽2俷8丄俵亖俀俀俉丏俀乯乮俆侽倗/侾侽侽倣倢悈乯傪壐傗偐偵壏傔側偑傜壛偊傞偲丄廘慺偑棷弌偡傞丅 偙傟傪俀夞峴側偭偰丄廘慺 俛倰 傪栺俀侽倣倢乮俇侽倗乯嶌偭偰偍偔丅乮悈憌偑偁偭偰傕峔傢側偄乯丂乮攔婥偡傞帠丄姺婥拲堄丄傾儞儌僯傾悈傪彮偟嶵偄偰偍偔偲娚榓偡傞乯
丂丂廘慺傪暘塼儘乕僩偵堏偟丄俆侽侽們們僼儔僗僐偵 儀儞僛儞乮俠6俫6丄俵亖俈俉丏侾丄倐倫丏俉侽丏侾亷乯俀俉丏俆倣倢偲 揝暣乮俥倕丄怗攠乯侾倗傪擖傟丄椻媝偟側偑傜廘慺傪揌壓偡傞丅摨帪偵丄摍検偺廘壔悈慺偑敪惗偡傞偺偱丄妋幚偵奜偵攔婥偡傞偐丄悈偐傾儖僇儕偵媧廂偝偣偰彍偔丅乮媡棳拲堄乯丂揌壓廔椆屻偼俇侽亷慜屻偵壏傔俁侽暘傛偔怳傝崿偤傞丅 乮廘壔悈慺偼廘慺偲堘偭偰僔儕僐儞僑儉丒僠儏乕僽傪怤偡偺偱 僥僼儘儞僥乕僾傪姫偄偰曗嫮偡傞乯
丂丂斀墳屻偺塼傪暘塼儘乕僩偵擖傟丄悈愻丄侾侽亾扽巁僇儕僂儉偱扙巁偡傞丅偙偺帪丄倫乮僷儔乯亅僕僽儘儌儀儞僛儞偺寢徎乮倣倫丏俉俆亷慜屻乯偑崿偠傞偺偱彮偟慡懱傪壏傔傞偲暘塼憖嶌偑偱偒傞丅丂柍悈墫壔僇儖僔僂儉乮棻忬乯偲怳傝扙悈偡傞丅丂嵟屻偼丄僆僀儖僶僗偱丄嵟弶偺棷暘偼幪偰丄乮桘偺壏搙偱乯俀俀侽亷慜屻偺棷暘傪庢傞丅丂忲棷巆熢偼 忢壏傑偱壓偑傞偲寢徎偡傞丅 僷儔埵偵擖傞偲 梈揰偑忋偑傞丅
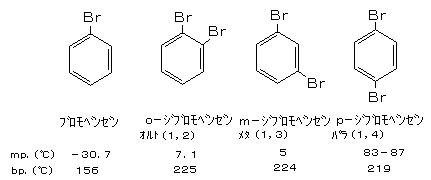
丂丂廂検丗丂僽儘儌儀儞僛儞乮俠6俫5俛倰丄倐倫丏侾俆俇亷丄兿侾丏俆侽乯 俁俆倗丄丂丂乮暃嶻暔丒忲棷巆熢偺 庡惉暘乯丂倫亅僕僽儘儌儀儞僛儞乮倫亅俠6俫4俛倰2丄倣倫丏俉俁亅俉俈亷丄倐倫丏俀侾俋亷丄兿侾丏俉係丄僷儔僕僋儘儖儀儞僛儞乮僷儔僝乕儖側偳乯偲摨偠偵偍偄乯 栺俋倗
丂丂丂丂丂
丂

丂丂丂

丂丂係丏丂儀儞僛儞僗儖儂儞巁僫僩儕僂儉偺嶌惉丗丂晠怘丒傗偗偳拲堄
丂丂屆偔偐傜僼僃僲乕儖崌惉偺尨椏偲偟偰嶌傜傟偰偒偨 儀儞僛儞僗儖儂儞巁僫僩儕僂儉乮俠6俫5俽俷3俶倎乯傪崌惉偟偰傒傞丅丂俀屄偺棸巁偑夝棧偟偰偱偒傞 嶰巁壔棸墿 俽俷3 偑媮揹巕帋栻偲側傝丄亅俽俷3亅 偑擖偭偰 俫亄偑弌傞丅
丂丂丂丂丂俫俷亅俽俷3丒俫丂亄丂俫2俽俷4丂佁丂俽俷3 乮嶰巁壔棸墿乯丂亄丂俫3俷亄 乮僆僉僜僯僂儉僀僆儞乯丂亄丂俫俽俷4亅 乮棸巁悈慺僀僆儞乯
丂丂丂丂丂
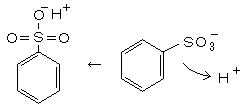 丄丂丂丂丂俫亄丂亄丂俫俽俷4亅丂仺丂俫2俽俷4 乮巁怗攠乯
丄丂丂丂丂俫亄丂亄丂俫俽俷4亅丂仺丂俫2俽俷4 乮巁怗攠乯丂丂棸巁偱偼斀墳懍搙偑抶偔乮偙偺斀墳偼壜媡揑偱丄棸巁偺擹搙偑俉侽亾埲壓偱偼斀墳偼媡偵恑傓乯丄敪墝棸巁偼崅壙偱偁傝丄偁傞偄偼嶌傝偵偔偄偺偱丄屲巁壔儕儞偱棸巁傪扙悈偟偰嶰巁壔棸墿偺妱崌傪憹傗偡傛偆偵偟偨丅丂屲巁壔儕儞乮屲巁壔擇儕儞丄俹2俷5乯 俀俈倗丄 棸巁乮俫2俽俷4丄俋俈亾乯 俇侽倣倢 傪俀俆侽們們僼儔僗僐偵擖傟丄椻媝娗乮仏 幨恀偺娨棳娗偱偼晄懌偩偭偨乯傪晅偗偰丄僆僀儖僶僗偱栺俀侽侽亷偵擬偟偰偍偔丅 儀儞僛儞俆侽倣倢傪備偭偔傝揌壓偡傞偲娨棳偟側偑傜寖偟偔斀墳偡傞丅
丂丂偙偺塼偺拞榓梡偵丄悈巁壔僫僩儕僂儉乮俶倎俷俫丄俋俁亾乯 俋俆倗傪 悈侾俆侽倣倢偵梟偐偟偰傛偔椻媝偟偰偍偄偨傕偺傪丄昘悈偱椻傗偟側偑傜丄廫暘拲堄偟偰嬵崬僺儁僢僩偱堦揌偢偮壛偊傞丅摿偵嵟弶偼旕忢偵寖偟偔斀墳偡傞偺偱丄杊岇柺丄僑儉庤戃傪偟偰峴側偄丄昿斏偵塼傪椻傗偡丅乮撍暒拲堄乯
丂丂拞榓偟廔偊偨傜丄僼儔僗僐傪暒揰嬤偔傑偱壛擬偟丄棸巁僫僩儕僂儉乮鋳徤乯偑擬悈偵梟偗偵偔偔丄栺俁俀亷傑偱偼堦掕偺梟夝搙偱偁傞偙偲傪棙梡偟偰丄孹泹偟偰忋悷傒傪暿偺價乕僇乕偵擖傟傞丅侾侽亷埲壓偱堦斢偍偔偲丄儀儞僛儞僗儖儂儞巁僫僩儕僂儉偺寢徎乮廮傜偐偄寉偄捑揳乯偑偱偒傞偺偱丄媧堷傠夁偟偰丄偦偺傑傑姡憞偡傞丅 傠塼傪彮偟幭媗傔偰椻傗偡偲 傕偆彮偟偲傟傞丅
丂丂棸巁僫僩儕僂儉側偳偺晄弮暔偑懡彮崿偠傞偑丄偦偺屻偺幚尡偵偼嵎偟忈傝偑側偄偺偱偙偆偡傞丅乮弮昳傪嶌傠偆偲偡傞偲偐側傝栚尭傝偡傞乯
丂丂乮仏丂悈巁壔僫僩儕僂儉偱拞榓偡傞戙傢傝偵丄夁忚検偺朞榓怘墫悈梟塼偵拲偄偱丄椻媝偡傞偲丄摨條偵 儀儞僛儞僗儖儂儞巁僫僩儕僂儉偺寢徎偑偱偒傞丅乯
丂丂儀儞僛儞僗儖儂儞巁傪悈巁壔僫僩儕僂儉偲梟梈偡傞乮偁傞偄偼丄崅埑壓偱僋儘儘儀儞僛儞偲悈巁壔僫僩儕僂儉悈梟塼偲斀墳偝偣傞乯偲丄僗儖儂婎傗僋儘儘婎偼揹巕媮堷惈偑戝偱偁傝丄悈巁壔暔僀僆儞 俷俫亅 偑媮妀抲姺斀墳傪婲偙偡偺偱丄僫僩儕僂儉丒僼僃僲僉僔僪乮僼僃僲乕儖偺僫僩儕僂儉墫乯偑惗惉偡傞丅丂偙傟傪巁偱拞榓偡傞偲僼僃僲乕儖乮俠6俫5俷俫乯偑梀棧偡傞丅
丂丂仏丂墫壔揝乮嘨乯偱掓怓斀墳乮巼乯傪尒傞応崌偼丄惓妋偵拞惈偵偟偰偍偔昁梫偑偁傞丅乮巁惈偱偼柍怓丄傾儖僇儕惈偱偼巁壔揝偑捑揳乯
丂丂丂
